近日,福建省乳腺癌精准诊治重点实验室主任、北京大学肿瘤医院云南医院(云南省肿瘤医院)张国君教授团队在国际知名期刊《Cancer Letters》发表了题为“YTHDF3 Drives Tumor Growth and Metastasis by Recruiting eIF4B to Promote Notch2 Translation in Breast Cancer”的研究论文。该研究首次揭示了m6A识别蛋白YTHDF3通过调控Notch2翻译促进乳腺癌上皮-间质转化(EMT)和转移的分子机制,并创新性开发了基于脂质纳米颗粒(LNP)的靶向治疗策略,为乳腺癌精准治疗提供了新方向。厦门大学医学院陈洪宇博士、林琳玲博士为共同第一作者,北京大学肿瘤医院云南医院(云南省肿瘤医院)张国君教授与白静雯副主任医师为共同通讯作者。研究获国家自然科学基金、云南省科技厅社会发展重点研发计划、云南省肿瘤医院横向项目和科研启动资金等基金的资助支持。

乳腺癌是全球女性发病率最高的恶性肿瘤,转移是导致患者死亡的主要原因。研究团队通过在线网站分析4142例乳腺癌患者临床数据发现,YTHDF3高表达与患者无复发生存期(RFS)显著缩短相关(HR=1.32, P<0.0001)。进一步实验表明,YTHDF3在三阴性乳腺癌细胞中表达尤为突出,其敲除可抑制癌细胞迁移、侵袭能力,并逆转EMT标志物蛋白表达。动物实验证实,YTHDF3敲除使皮下移植瘤体积减少50%(P=0.0014),肺转移面积降低39%(P<0.0001),显著延长荷瘤小鼠生存期。
机制研究表明,YTHDF3通过特异性识别Notch2 mRNA第4854位点的m6A修饰,招募翻译起始因子eIF4B,显著提升Notch2蛋白合成效率,而非影响其mRNA稳定性。Notch2过表达可部分挽救YTHDF3敲除导致的EMT抑制,反之Notch2敲低则逆转YTHDF3过表达的促转移效应。这一发现首次揭示了YTHDF3-eIF4B-Notch2轴在乳腺癌转移中的作用,为靶向干预提供了理论依据。
基于上述机制,研究团队设计了一种搭载YTHDF3 siRNA和近红外荧光染料ICG的脂质纳米颗粒(Lip-ICG/siYTHDF3)。该纳米颗粒粒径约135 nm,表面电荷+35 mV,在体内可长效靶向肿瘤区域(持续富集达5天)。动物实验显示,Lip-ICG/siYTHDF3治疗组皮下瘤体积减少55%(P=0.0009),肺转移信号强度降低70%(P=0.0079),且通过ICG荧光成像实现了治疗过程的实时可视化监测。安全性评估表明,该纳米颗粒无明显肝肾毒性,血液指标均处于正常范围。
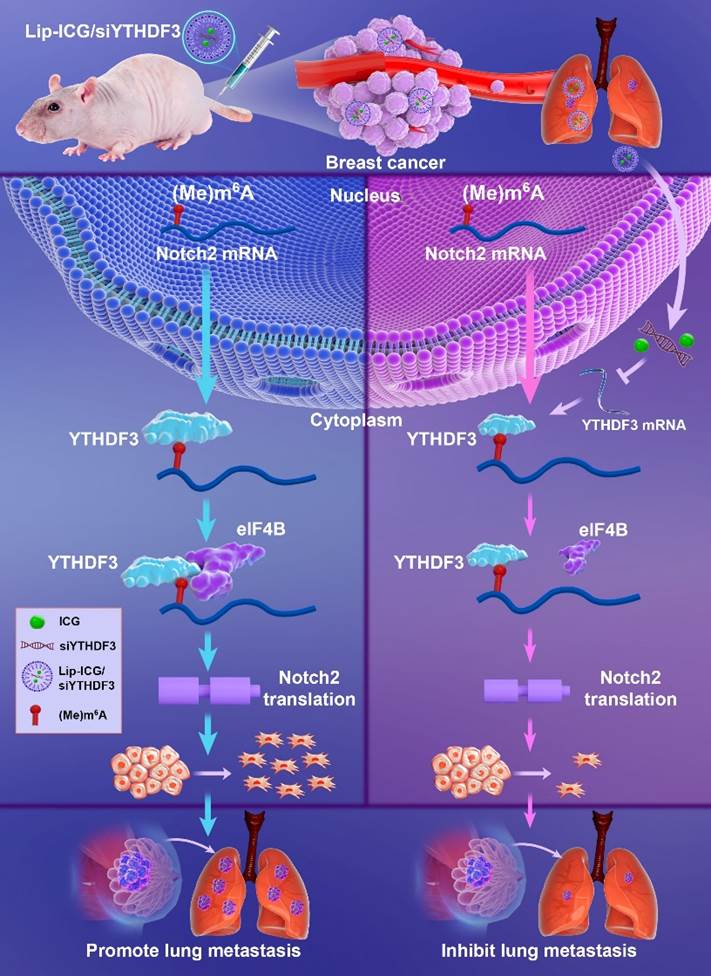
本研究不仅首次发现YTHDF3对Notch2的调控作用,并阐明了YTHDF3-Notch2轴在乳腺癌转移中的关键作用,还为基于m6A调控网络的靶向治疗提供了新策略。目前,团队正进一步优化纳米颗粒的靶向性与量子产率,并探索其对骨、肝等其他转移灶的抑制效果。研究者表示,该技术有望在未来进入临床前试验阶段,为晚期乳腺癌患者提供更高效的治疗选择。
张国君教授致力于乳腺癌基础和临床研究30余年,在乳腺癌发生发展与转移机制、精准外科手术导航等方面取得诸多创新性成果,在Nature Protocols, Nature Medicine, Signal Transduction and Targeted Therapy, Science Translational Medicine,Advanced Science, Clinical Cancer Research等国际知名学术期刊上发表超百篇论文。主要研究方向有:1. 乳腺癌的基础研究;2. 分子影像学与肿瘤精准治疗的临床转化研究;3. 智能医学与肿瘤多学科综合诊治研究。欢迎广大优秀学子及临床、科研人员报考硕、博研究生及博士后合作研究。邮箱:zhangguojun@kmmu.edu.cn。